Фібронектин є глюкопротеїном і відіграє важливу роль у утриманні клітин організму разом або у згортанні крові. Він бере на себе багато різних функцій в організмі, які пов'язані з його здатністю розвивати адгезивні сили. Структурні помилки в структурі фібронектину можуть призвести до сильної слабкості сполучної тканини.
Що таке фібронектин?
Фібронектин - це глюкопротеїн з молекулярною масою 440 кДа (кілодальтони). Він використовується для вироблення адгезійних сил між клітинами, між клітинами тіла та різними субстратами, між клітинами тіла та міжклітинним матриксом, а також між тромбоцитами крові під час згортання крові. Тому він підтримує загоєння ран, ембріогенез, гемостаз, адгезію клітин під час міграції клітин або зв'язування антигену з фагоцитами.
Первинний фібронектин містить 2355 амінокислот і утворює 15 ізоформ. Він виникає як у позаклітинної області, так і всередині клітин організму. Поза клітинами це нерозчинний білок, а всередині клітини плазма - це розчинний білок. Всі форми фібронектину кодуються одним і тим же геном FN1. Розчинний фібронектин містить дві ланцюги ізомерних білків, пов'язаних дисульфідним мостом. У разі нерозчинного фібронектину ці молекули знову з'єднуються між собою через дисульфідні мости, щоб утворити фібрилоподібну структуру.
Анатомія та структура
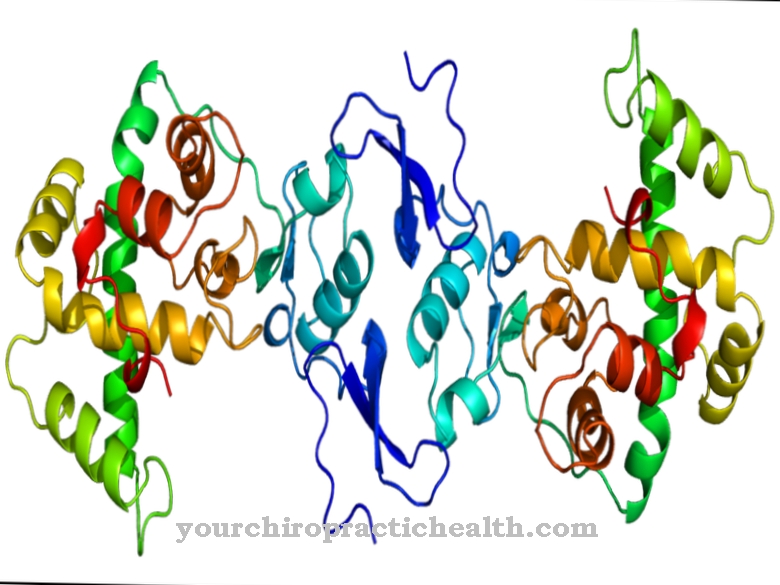
У своїй основній структурі фібронектин - це гетеродимер, що складається з двох стрижневих білкових ланцюгів, які пов'язані дисульфідним мостом. Ланцюги ізомерного білка експресуються тим же геном, геном FN1. Різна послідовність основ є результатом альтернативного сплайсингу цього гена. Кожен ген містить екзони та інтрони. Екзони - це секції, які переводяться в структуру білка. На відміну від цього, інтрони - неактивні сегменти генів. При альтернативному сплайсингу послідовність пар основ залишається однаковою, але екзони та інтрони зустрічаються на різних сегментах генів. При перекладі генетичної інформації розбірливі екзони зливаються і інтрони вирізуються. Цей альтернативний переклад однієї і тієї ж генетичної інформації дозволяє утворити з одного і того ж гена кілька ланцюгів ізомерних білків.
Фібронектин, що складається з двох ізомерних білкових ланцюгів, є розчинним, утворюється в печінці і надходить у плазму крові. Там він відповідає за згортання крові як частини загоєння ран та регенерації тканин. Нерозчинний фібронектин виробляється в макрофагах, ендотеліальних клітинах або фібробластах. Він містить ту саму основну структуру. Однак тут окремі молекули фібронектину в свою чергу з'єднуються одна з одною дисульфідними містками, утворюючи фібрилярні білкові структури, що утримують клітини разом.
Здатність розвивати адгезійні сили обумовлена часто зустрічається амінокислотною послідовністю аргінін - гліцин - аспартат. Це призводить до адгезії фібронектину до так званих інтегринів (рецепторів адгезії на поверхні клітин). Білкові ланцюги фібронектину складаються з багатьох доменів, які містять від 40 до 90 амінокислот. Внаслідок гомології доменів ланцюги поліпептидів фібронектину поділяються на три структурні типи I, II і III.
Функція та завдання
Фібронектин, як правило, служить для утримання певних структурних одиниць разом. До них належать клітини, позаклітинний матрикс, певні субстрати або навіть тромбоцити крові. Раніше називали фібронектин Клітинний клей призначений. Це забезпечує, що клітини в тканинах залишаються разом і не розходяться.
Він також відіграє головну роль у міграції клітин. Навіть стикування макрофагів з антигенами опосередковується фібронектином. Крім того, фібронектин контролює багато процесів ембріогенезу та клітинної диференціації.
Однак фібронектин часто знижується при злоякісних пухлинах. Це дає можливість пухлині перерости в тканини і утворювати метастази шляхом розщеплення пухлинних клітин.
Розчинний фібронектин у плазмі крові дає можливість утворення тромбів, щоб закрити кровотечу рани. Окремі тромбоцити крові склеюються через утворення фібрину. Як опсонін, фібронектин зв’язується з поверхнею макрофагів як рецептори. За допомогою цих рецепторів макрофаги можуть зв’язувати та включати певні хвороботворні частинки. У позаклітинному просторі нерозчинний фібронектин відповідає за утворення матриці, яка фіксує клітини.
Хвороби
Дефіцит або структурні порушення фібронектину часто мають серйозні наслідки для здоров'я. Внаслідок росту раку всередині пухлини концентрація фібронектину падає. Клітинна структура пухлини розпушується і клітини розсуваються. Це призводить до частих метастазів через розщеплення пухлинних клітин та їх міграцію через лімфатичну систему або плазму крові до інших частин тіла. Крім того, через брак фібронектину ракові клітини можуть швидше перерости в сусідню тканину і тим самим витіснити її.
Крім того, існують спадкові захворювання, які призводять до дефекту сполучної тканини. Один із прикладів - синдром Елера-Данлоса. Синдром Елера-Данлоса не є рівномірним захворюванням, а являє собою комплекс дефектів сполучної тканини, тип X викликаний відсутнім або дефектним фібронектином. Це мутація в гені FN1. Це призводить до різкої слабкості сполучної тканини. Стан успадковується як аутосомно-рецесивна ознака. Він проявляється в дуже провислої шкірі і перевтомовості суглобів. Незважаючи на великі відмінності в причині слабкої сполучної тканини, симптоми окремих захворювань цього комплексу схожі. За датським дерматологом Едвардом Елерсом та французьким дерматологом Анрі-Александром Данлосом, кардинальними симптомами синдрому Елерса-Данлоса є сильна перенапруженість і гнучкість шкіри.
Нарешті, певна мутація гена FN1 також може призвести до гломерулопатії (захворювань тільців нирок). Це серйозне захворювання нирок, яке часто вимагає діалізного лікування.